流程验证包括三个相互关联的阶段
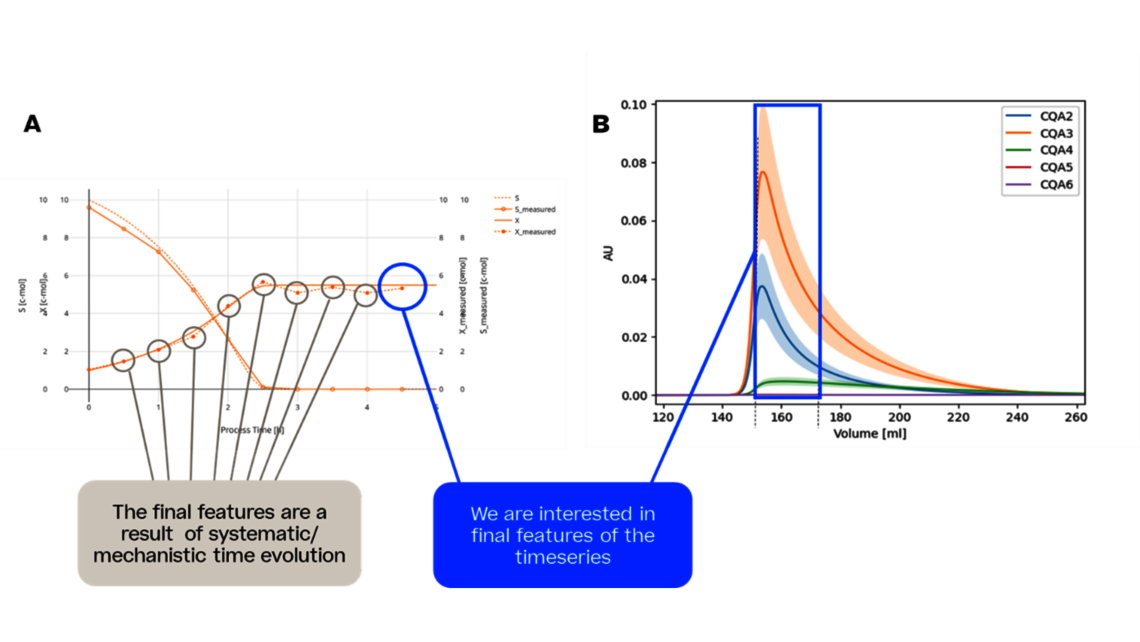
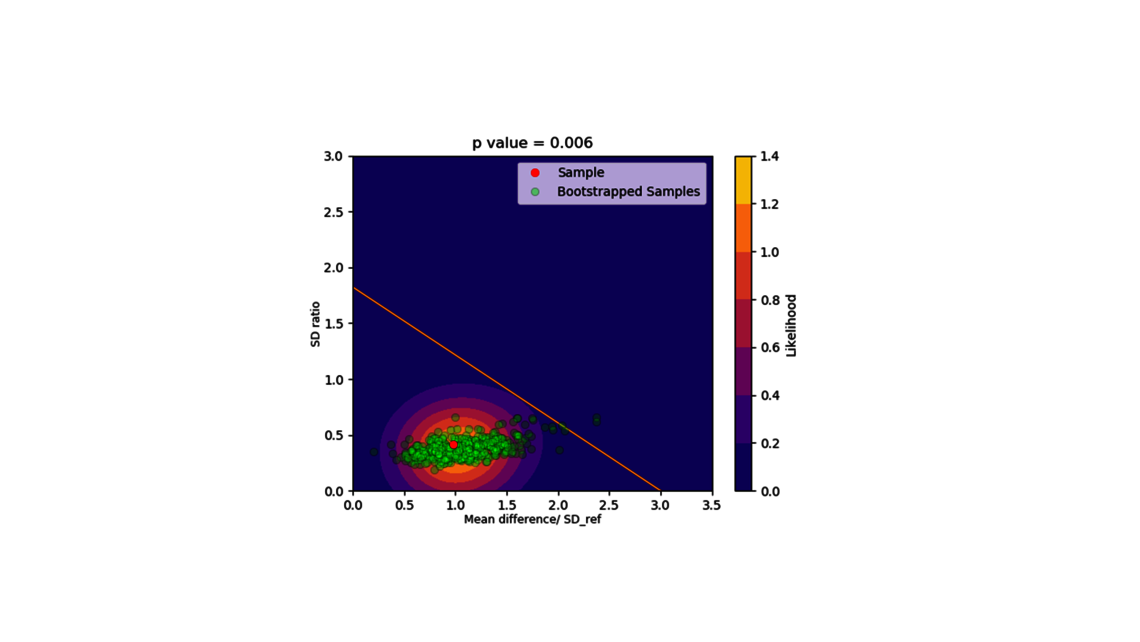
第一个步骤是工艺表征,这是根据 FDA、EMA 和 ICH 指南制定控制策略的最基本步骤,可确保产品质量的一致性。为实现这一目标,需要了解并控制工艺输入(工艺参数、材料属性)与工艺输出(关键质量属性、产品数量)之间的关系。这种关系可以从数据和先前的知识中获知。
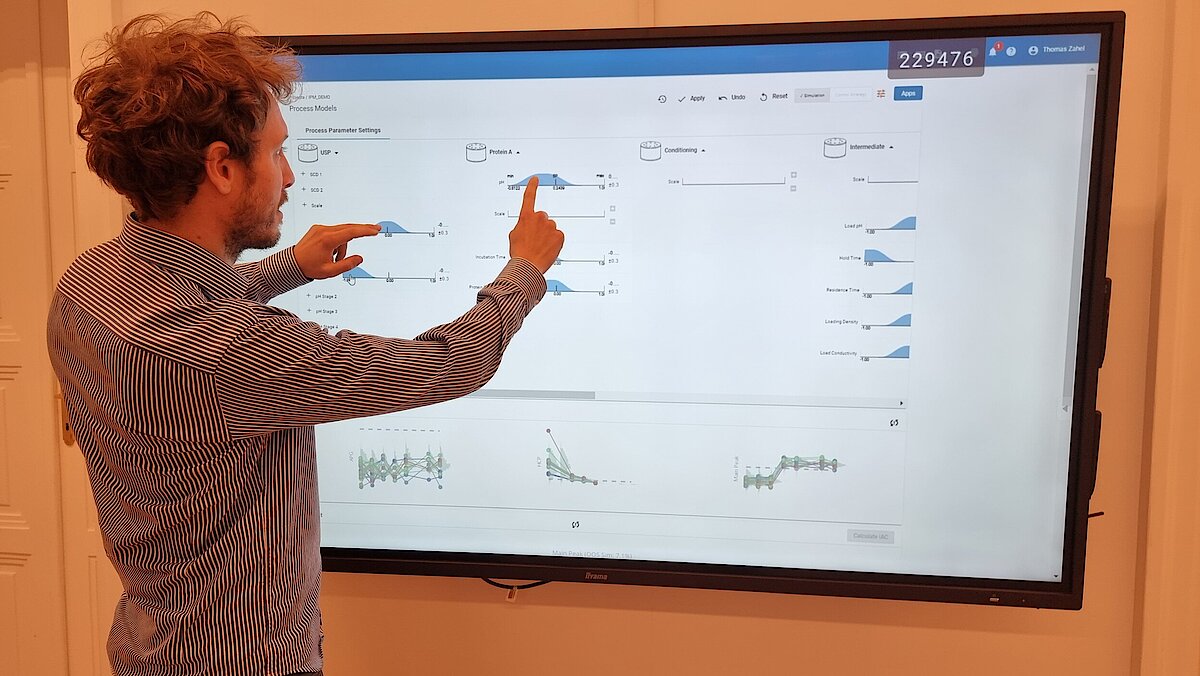
我们独特的工作流程可指导您完成这一关键阶段,包括:
- 风险评估
- 缩小模型的建立和比较
- 实验设计(用于统计和动态模型)
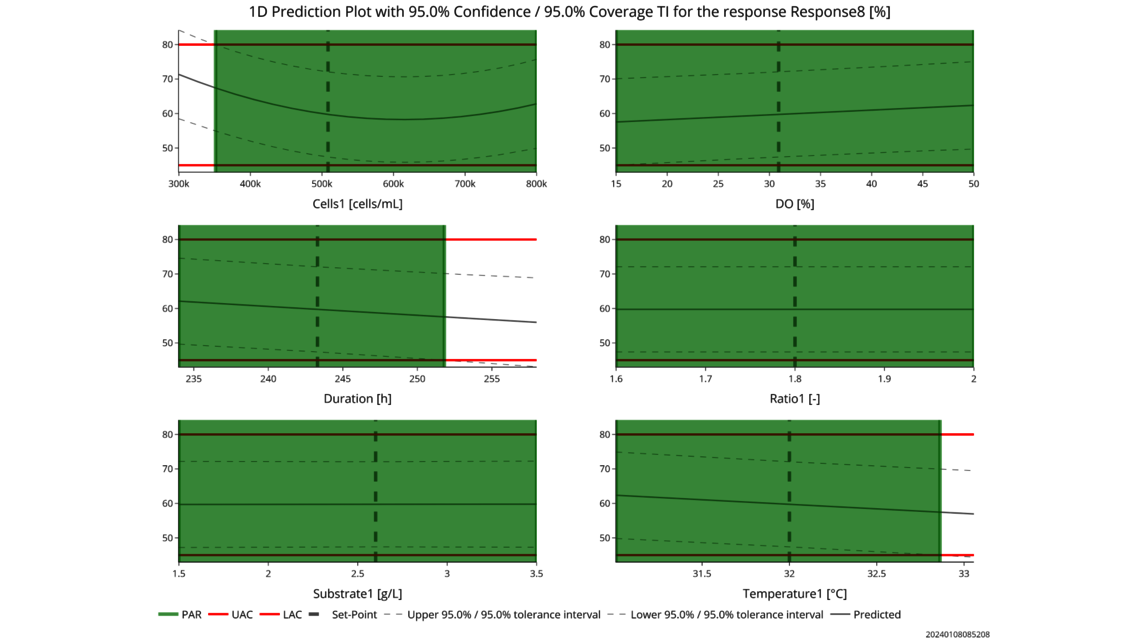
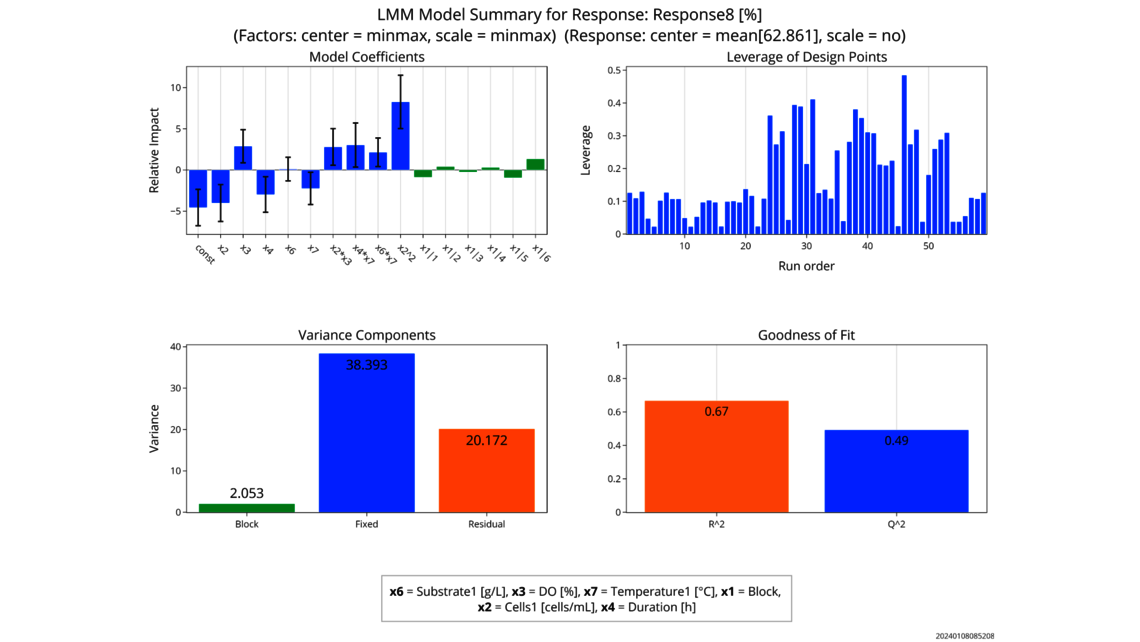
- 实验分析和临界值评估(线性回归模型、包括随机效应的线性混合模型、上下游动态模型)
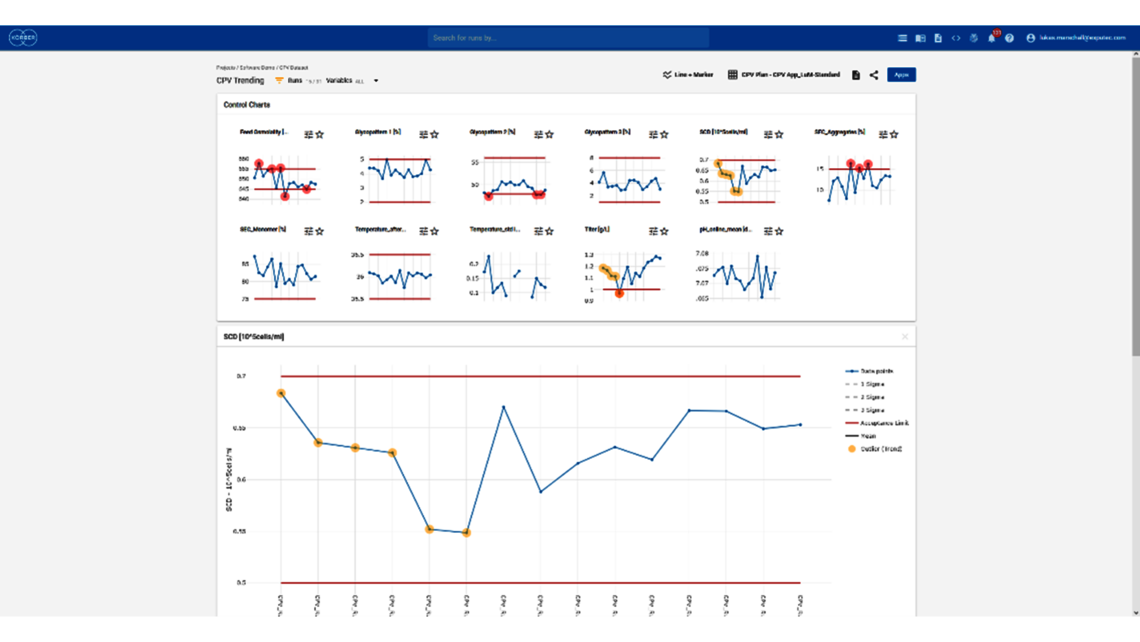
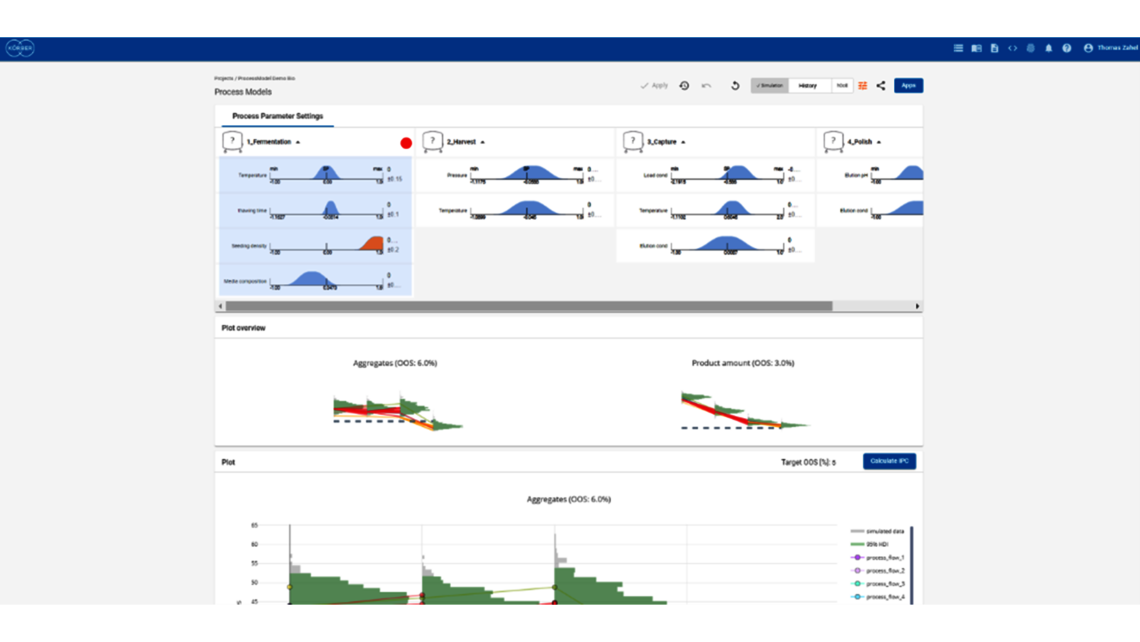
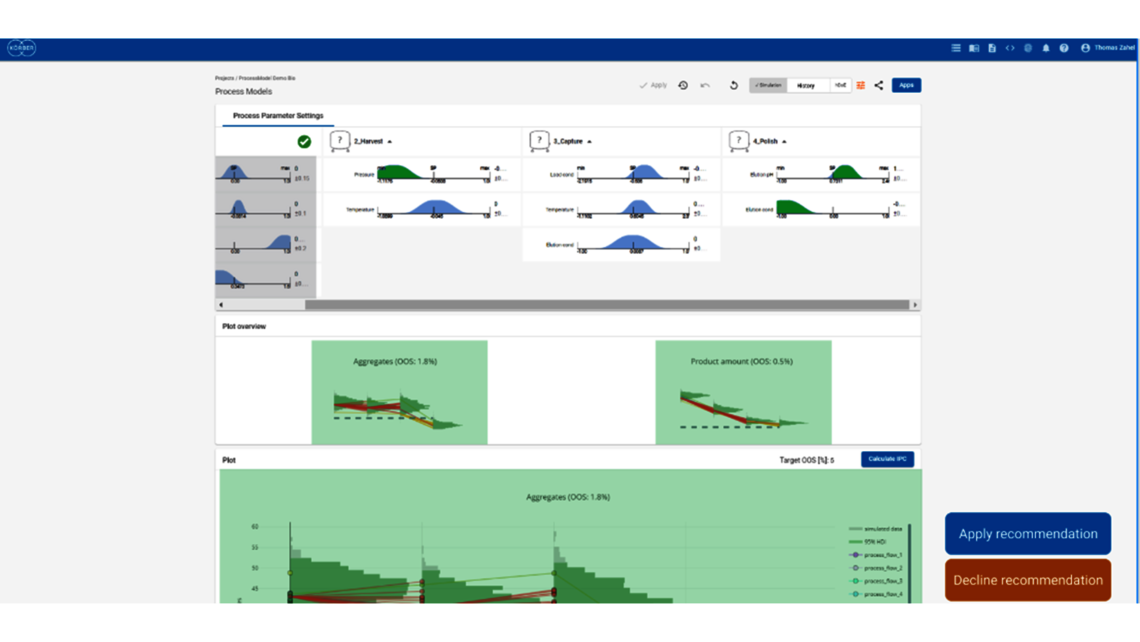
- 利用端到端流程建模框架制定整体控制策略
我们拥有十多年的经验,参与了二十多个产品的商业化,与监管机构进行了富有成效的交流,在单克隆抗体、重组蛋白、pDNA 等不同产品领域积累了丰富的专业知识。
我们与勃林格殷格翰( Boerhinger-Ingelheim) 和武田制药(Takeda) 等大型制药公司合作发表了 10 多篇同行评审论文,证明了我们方法的有效性。在最近的同行评审科学出版物中,我们证明了我们的方法通过利用自学数字阴影(digital shadows),减少了所需实验数量的 50%以上。这种方法还在许多会议上进行了展示,例如,2023 年ISPE生物技术会议。
我们为您提供以下支持:
- 将实验数量减少 50% 以上,加快产品上市速度
- 根据 ICH Q9 / ICH Q12 进行监管认可的工作流程和风险评估
- 根据 ICH Q8 制定整体控制策略,尽可能拓宽 PAR 和设计空间
- 基于数据的工艺参数关键性评估
- 及时交付结果