Die Prozessvalidierung besteht aus drei Stufen, die miteinander verknüpft sind.
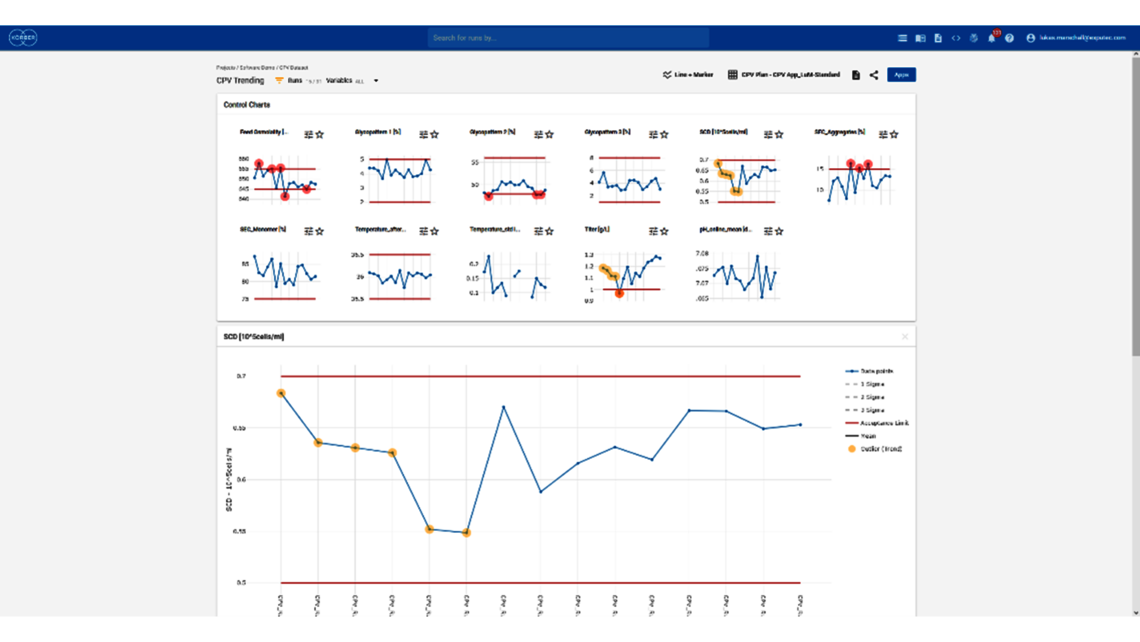
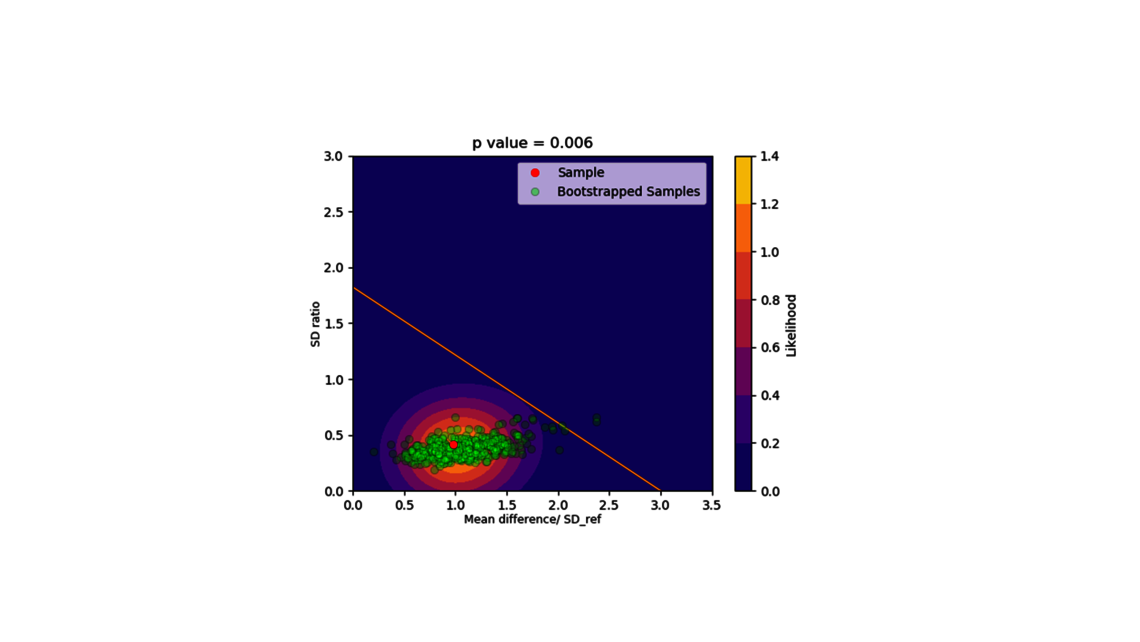
Die erste Stufe, die Prozesscharakterisierung, ist der wichtigste Schritt, um eine Kontrollstrategie gemäß den FDA-, EMA- und ICH-Richtlinien zu etablieren, die eine gleichbleibende Produktqualität gewährleistet. Um diese Aktivität zu erreichen, muss die Beziehung zwischen dem Prozess-Input (Prozessparameter, Materialeigenschaften) und dem Prozess-Output (kritische Qualitätsmerkmale, Produktmenge) verstanden und kontrolliert werden. Diese Beziehung kann aus Daten und Vorwissen gelernt werden.
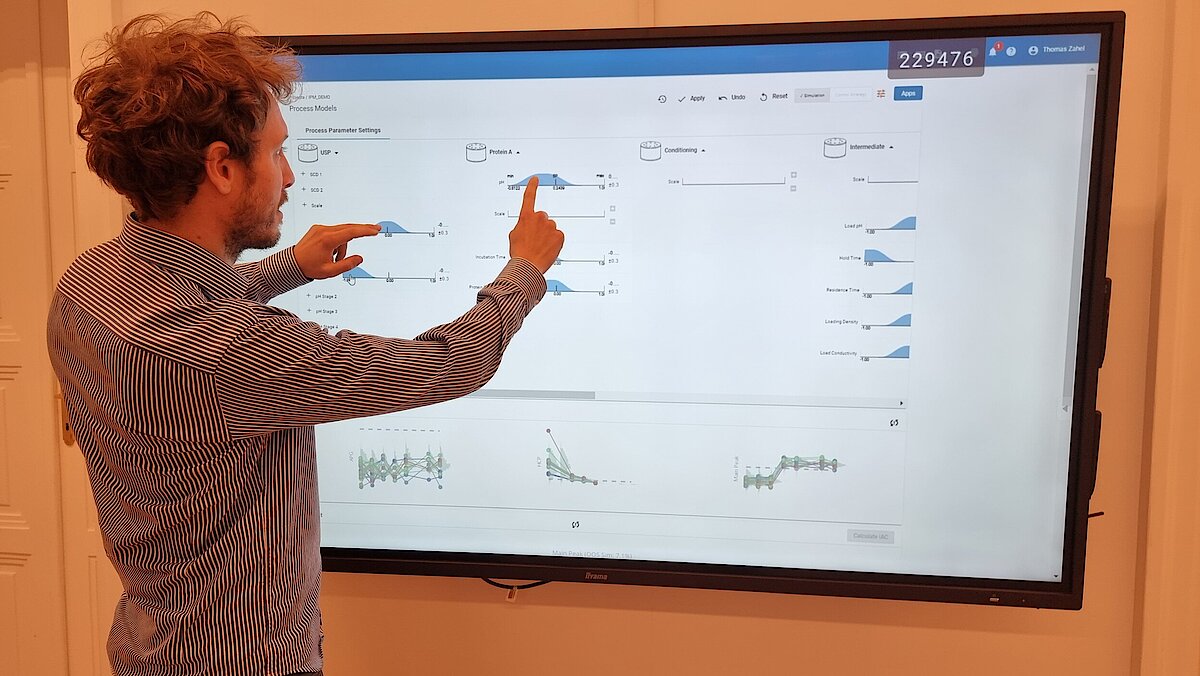
Unser einzigartiger Workflow führt Sie durch diese kritische Phase, die Folgendes umfasst:
- Risikobewertung
- Etablierung und Vergleich von Scale-down-Modellen
- Experimentelles Design (für statistische und dynamische Modelle)
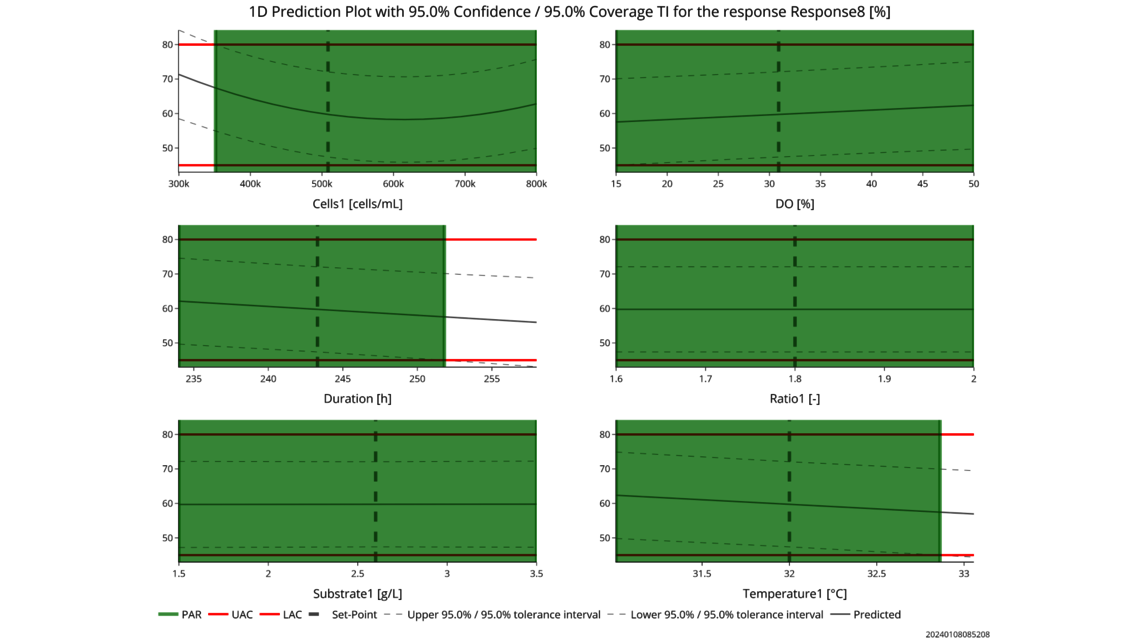
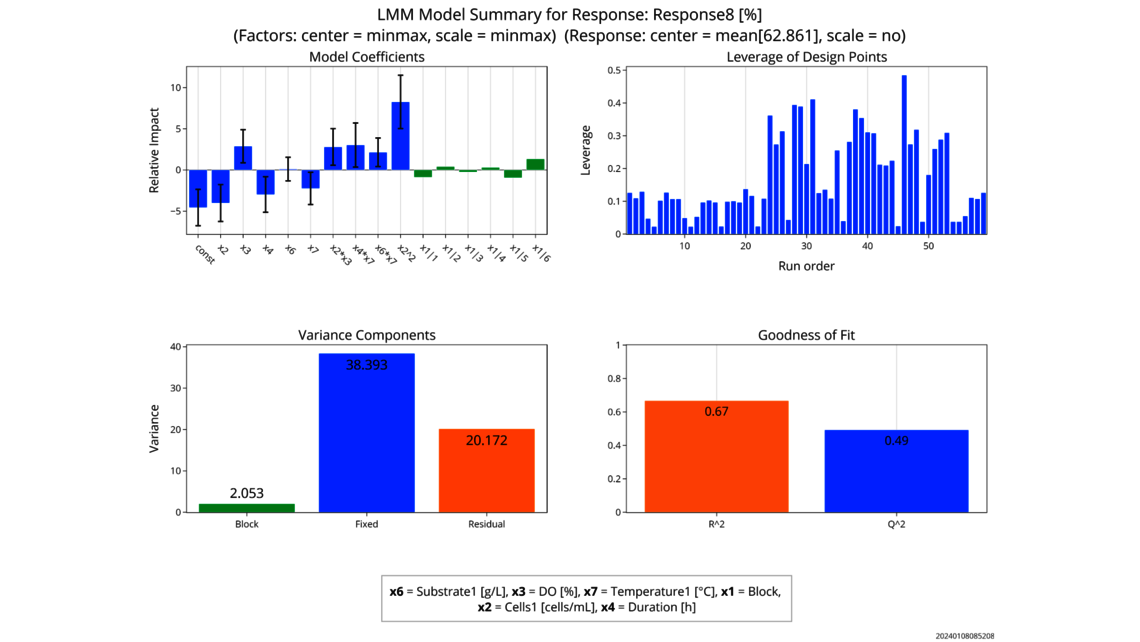
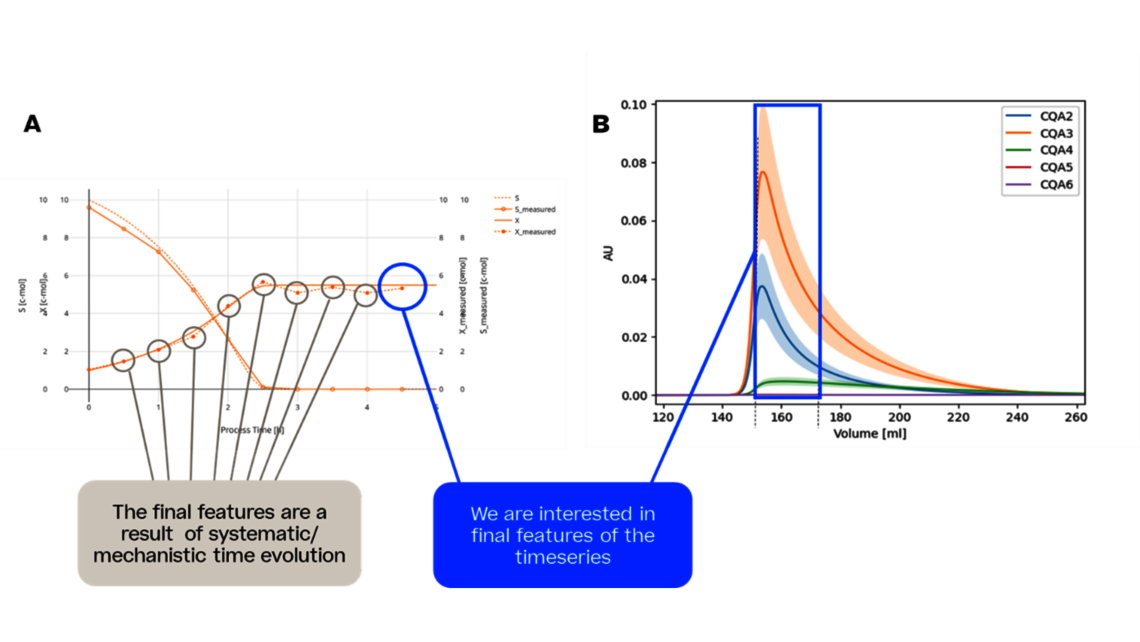
- Experimentelle Analyse und Kritikalitätsbewertung (lineare Regressionsmodelle, lineare gemischte Modelle mit Zufallseffekten, dynamische Modelle für Up- und Downstream)
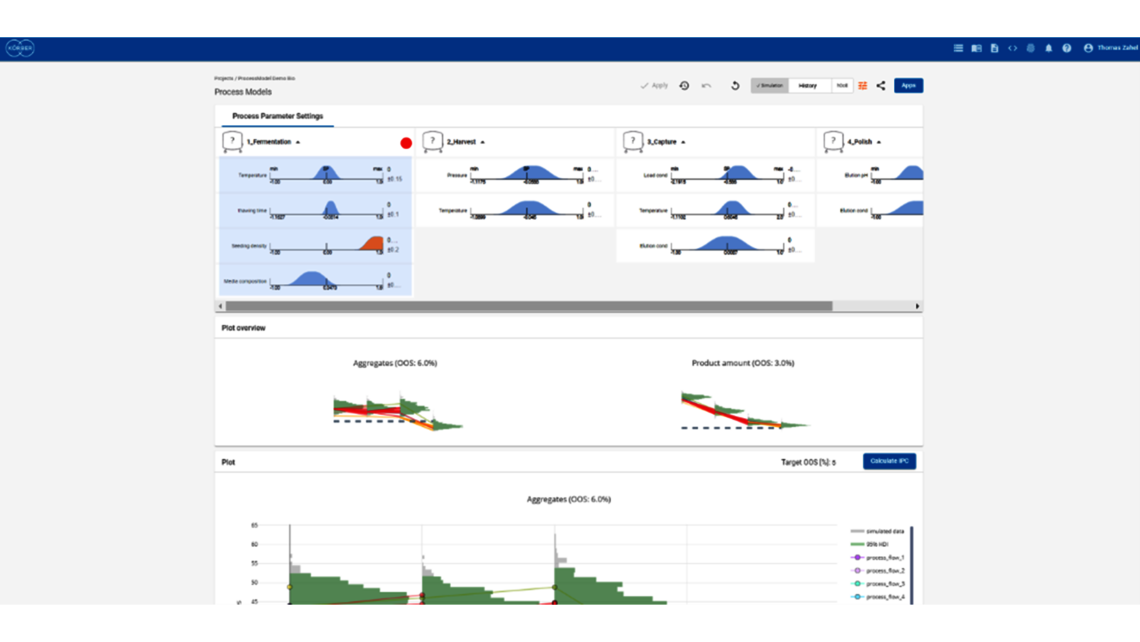
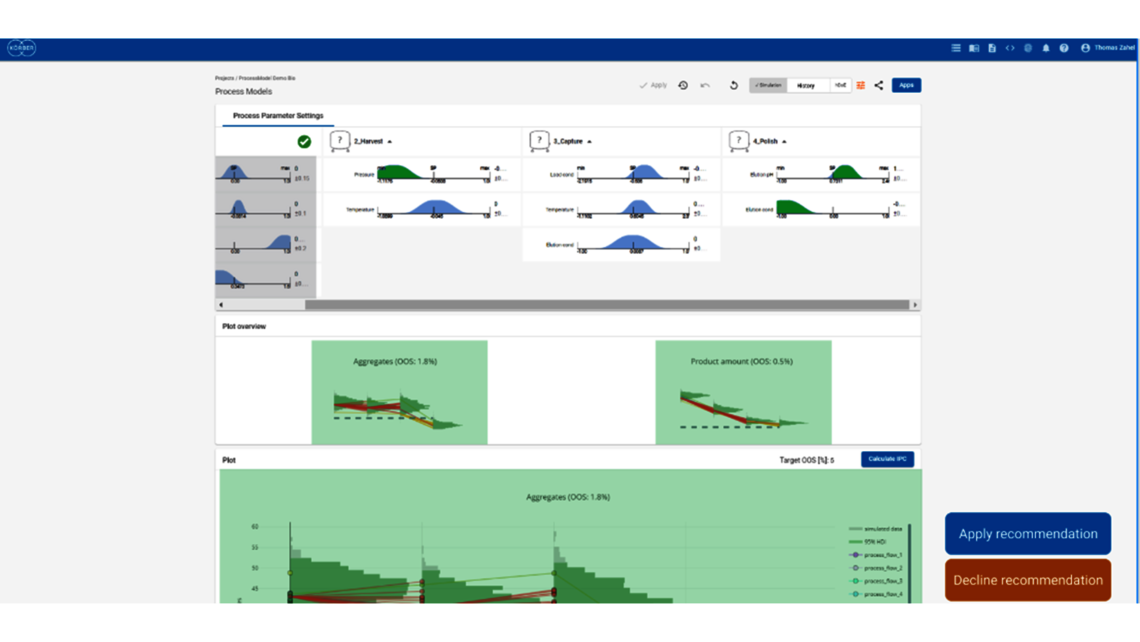
- Festlegung einer ganzheitlichen Kontrollstrategie unter Verwendung von End-to-End-ProzessmodellenMit über einem Jahrzehnt Erfahrung und Beteiligung an mehr als 20 Produktkommerzialisierungen haben wir einen produktiven Austausch mit den Regulierungsbehörden gefördert und Expertise in verschiedenen Produktbereichen wie monoklonalen Antikörpern, rekombinantem Protein, pDNA und mehr erlangt.
Wir haben über 10 peer-reviewed Fachartikel mit großen Pharmaunternehmen wie Boehringer Ingelheim und Takeda veröffentlicht, die die Wirksamkeit unseres Ansatzes demonstrieren. In einer kürzlich erschienenen wissenschaftlichen Publikation haben wir gezeigt, dass unsere Methode zu einer Reduzierung von über 50% der erforderlichen Experimente führt, indem sie selbstlernende digitale Schatten nutzt. Diese Methode wurde bereits auf vielen Konferenzen wie der ISPE Biotechnology Conference 2023 vorgestellt.
Wir unterstützen Sie mit:
- Schnellerer Markteinführung durch Reduzierung der Anzahl der Experimente um mehr als 50%
- Regulatorisch akzeptierte Arbeitsabläufe und Risikobewertungen gemäß ICH Q9 / ICH Q12
- Ganzheitliche Kontrollstrategien, die gemäß ICH Q8 zu möglichst breiten PARs und Designräumen führen
- Datenbasierte Kritikalitätsbewertung von Prozessparametern
- Pünktliche Lieferung von Ergebnissen