Im dynamischen Umfeld der pharmazeutischen Produktion werden durch die Integration hochmoderner Technologien die Industriestandards neu gestaltet. In diesem Artikel enthüllen wir das bahnbrechende Potenzial von digitalen Zwillingen von Gesamtprozessen – auch als integrierte Prozessmodelle (IPMs) bekannt – welche die Zukunft der (bio-)pharmazeutischen Industrie neu definieren. Von der verbesserten Fertigungsflexibilität bis zur schnelleren Produkteinführung – wir zeigen auf, wie diese dynamischen Tools Entscheidungsprozesse in Echtzeit revolutionieren. Darüber hinaus ergründen wir die Synergien, die durch die Integration digitaler Zwillinge in MES-Software erreicht werden und aus denen sich neue Möglichkeiten für die Echtzeit-Kontrolle und -Freigabe von Chargen ergeben.
Digitale Zwillinge wurden erstmals 2002 von Dr. Michael Grieves an der University of Michigan beschrieben. Im Laufe der letzten Jahre hat dieser Begriff in zahlreichen Branchen große Aufmerksamkeit erlangt, darunter auch der pharmazeutischen Industrie. Aber was genau sind eigentlich digitale Zwillinge, und auf welche Weise revolutionieren sie das pharmazeutische Umfeld?
Es gibt zahlreiche Definitionen von digitalen Zwillingen, aber eine spricht uns ganz besonders an – nämlich die von IBM¹. Gemäß deren Definition handelt es sich bei einem digitalen Zwilling um „die virtuelle Abbildung eines Objekts oder eines Systems. Diese Abbildung umfasst seinen gesamten Lebenszyklus, wird aus Echtzeitdaten aktualisiert und setzt Simulation, maschinelles Lernen und Schlussfolgerungen als Unterstützung zur Entscheidungsfindung ein.“ Dabei hebt IBM hervor, dass digitale Zwillinge mehr sind als umfangreiche Simulationsmodelle. Es handelt sich um dynamische Tools, welche fortlaufend von neuen Daten lernen, zukünftige Ergebnisse vorhersagen und Präventivmaßnahmen vorschlagen. Auf diese Weise können die Prozesseffizienz signifikant erhöht, Risiken verringert und die Gesamtleistung verbessert werden.
Im Bereich der Prozessmodellierung und der digitalen Transformation der Fertigung können digitale Zwillinge entweder auf bestimmte Prozessschritte spezialisiert oder holistisch ausgelegt sein. Dadurch wird das gesamte Spektrum des Produktionsprozesses abgedeckt. Dieser Artikel befasst sich eingehend mit den Vorteilen des letztgenannten Ansatzes, der in der biopharmazeutischen Industrie als digitale Zwillinge von Gesamtprozessen oder integrierte Prozessmodelle (IPMs) bezeichnet wird.
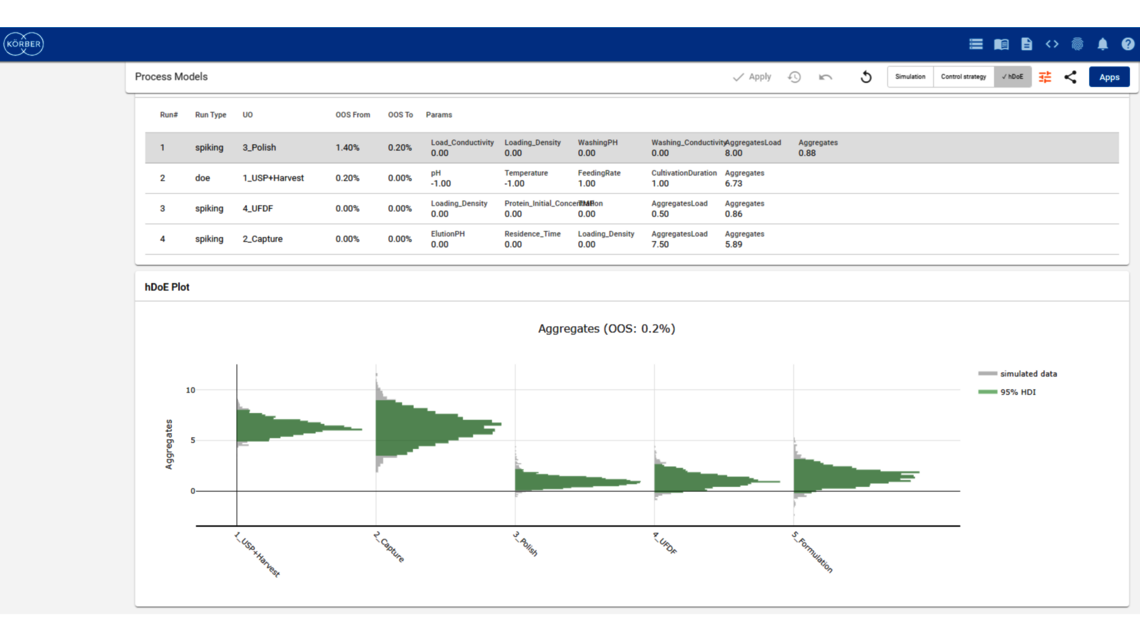
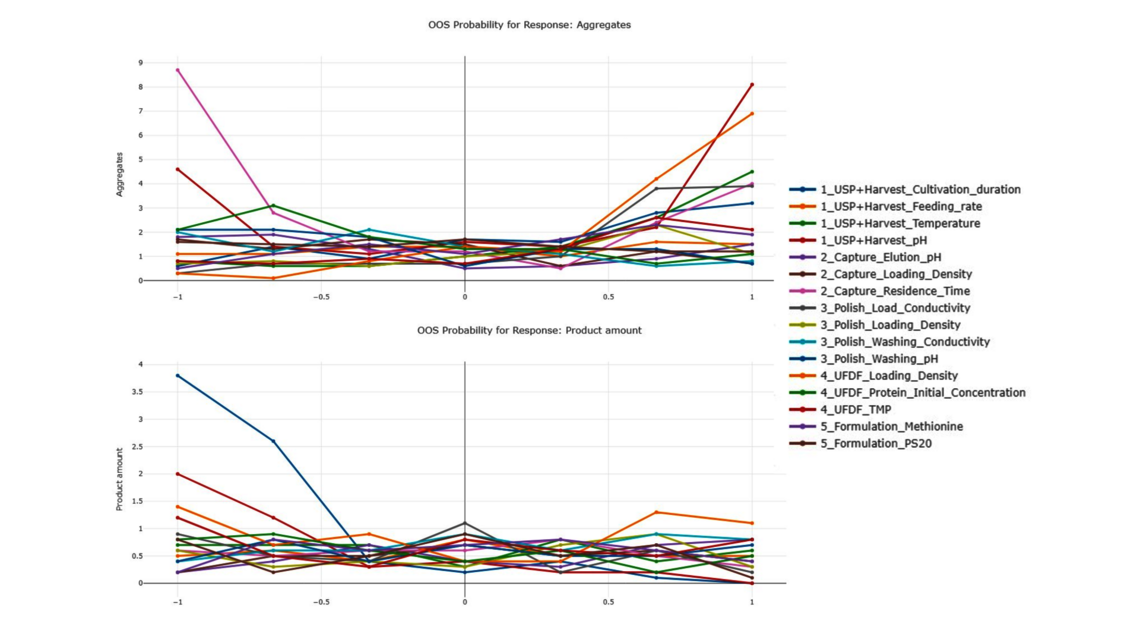
Das Ziel eines jeden biopharmazeutischen Herstellprozesses besteht darin, die Produktwirksamkeit und die Patientensicherheit kontinuierlich zu gewährleisten und gleichzeitig die Ausbeute zu maximieren. Dies wird durch die Qualität des Arzneimittelwirkstoffs bzw. Arzneimittelprodukts definiert, die am Ende des Prozesses erreicht wird. Biopharmazeutische Herstellprozesse umfassen jedoch typischerweise fünf bis zehn verschiedene Prozessschritte. Wie lässt sich demnach die Leistung zwischengeschalteter Prozessschritte mit der Qualität des Endprodukts verknüpfen? Wie können wir die Prozessschritte ermitteln, die sich am stärksten auf die Produktqualität auswirken, sodass wir dort entsprechend mehr Ressourcen einsetzen können? Benötigen wir unbedingt gleichermaßen exakte Modelle für alle Prozessschritte? Diese zentralen Fragen können nur mit einem holistischen Ansatz adressiert werden, welcher den gesamten Fertigungsprozess lückenlos umfasst und alle Prozessschritte in einem einheitlichen Modell integriert.
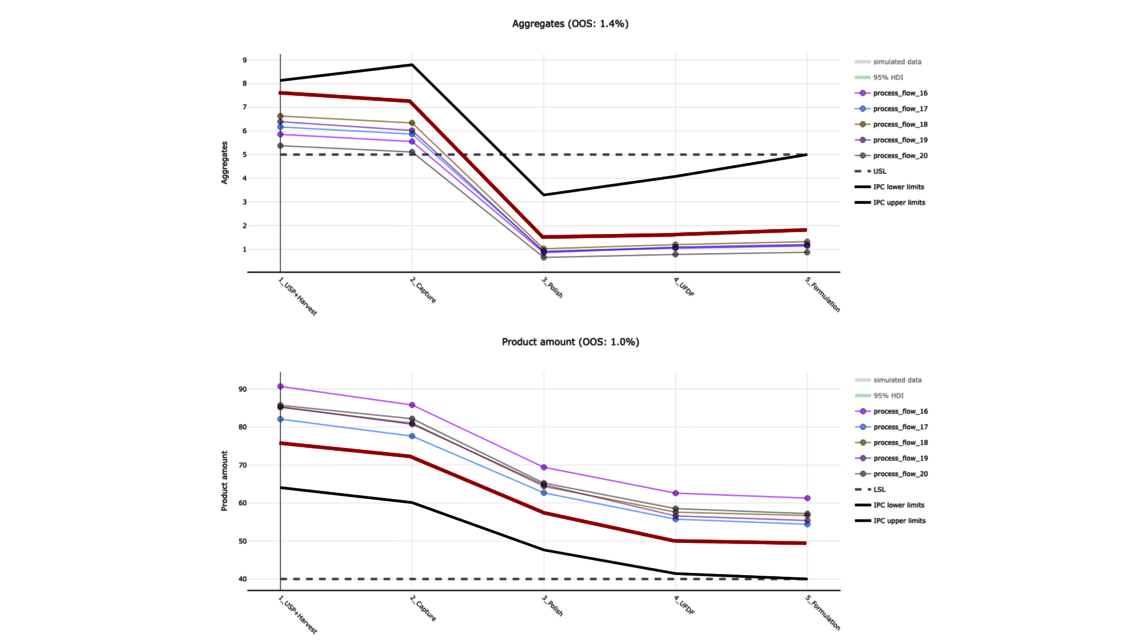
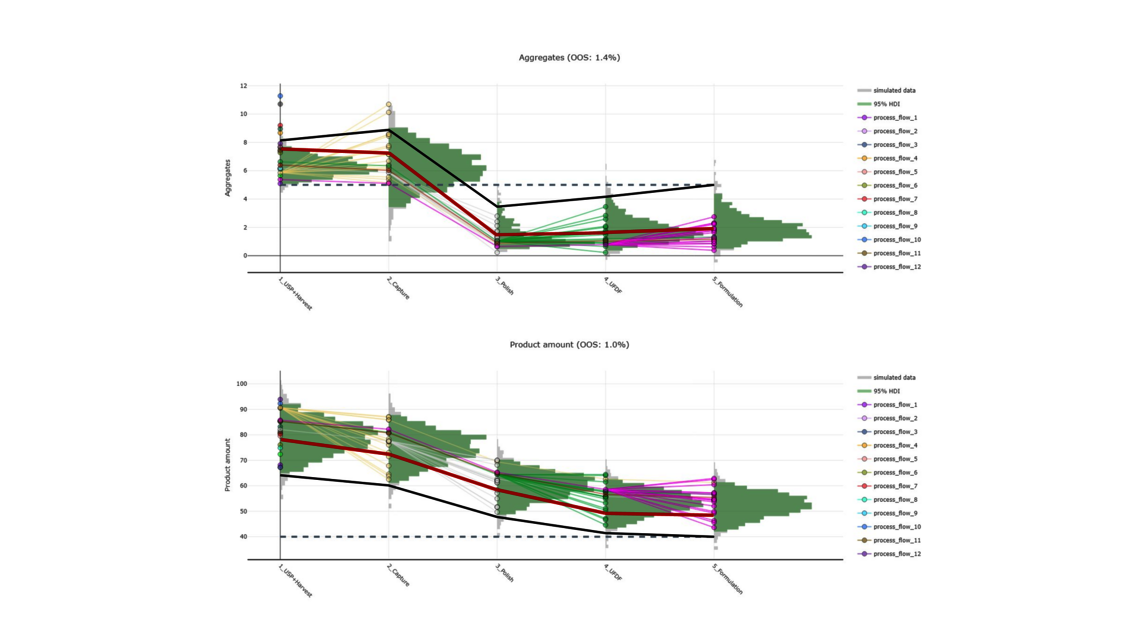
In diesem Blogartikel werden auf der Grundlage eines Demo-Datensatzes, der einen vereinfachten industriellen Herstellprozess von monoklonalen Antikörpern (mAb) abbildet, die Vorteile von digitalen Zwillingen von Gesamtprozessen aufgezeigt. Der Datensatz umfasst fünf Kampagnen im Produktionsmaßstab in fünf verschiedenen Prozessschritten (nachfolgend mit UO abgekürzt, vom Englischen „unit operations“) sowie 15 „Design of Experiment“-Läufen (DoE) pro UO. Dies ist eine übliche Datensatzgröße während der Prozessvalidierungsphase 1 in der biopharmazeutischen Industrie. Es werden zwei Ausgangsgrößen modelliert: Aggregate (ein Critical Quality Attribute bzw. CQA) und Produktmenge (ein Key Performance Indicator bzw. KPI).