Viele Unternehmen stehen vor der Herausforderung, die Entwicklungszeiten zu verkürzen und Prozesse effizient zu optimieren, um Medikamente schneller auf den Markt zu bringen. In diesem Artikel stellen wir einen dynamischen Modellierungsansatz vor, der zu einer neuen Ära schneller und effizienter Produktentwicklung in der Bioprozesstechnologie beiträgt.
In einer Welt, in der sich die Landschaft der Bioprozessentwicklung ständig verändert, ist eine schnellere Prozessentwicklung bei gleichbleibender Produktqualität und Prozesseffizienz das Gebot der Stunde. Dies hilft nicht nur den Herstellern, ihre Herstellungskosten zu senken, sondern auch den Patienten die Medikamente schneller zur Verfügung zu stellen, was für beide Seiten eine Win-Win-Situation darstellt.
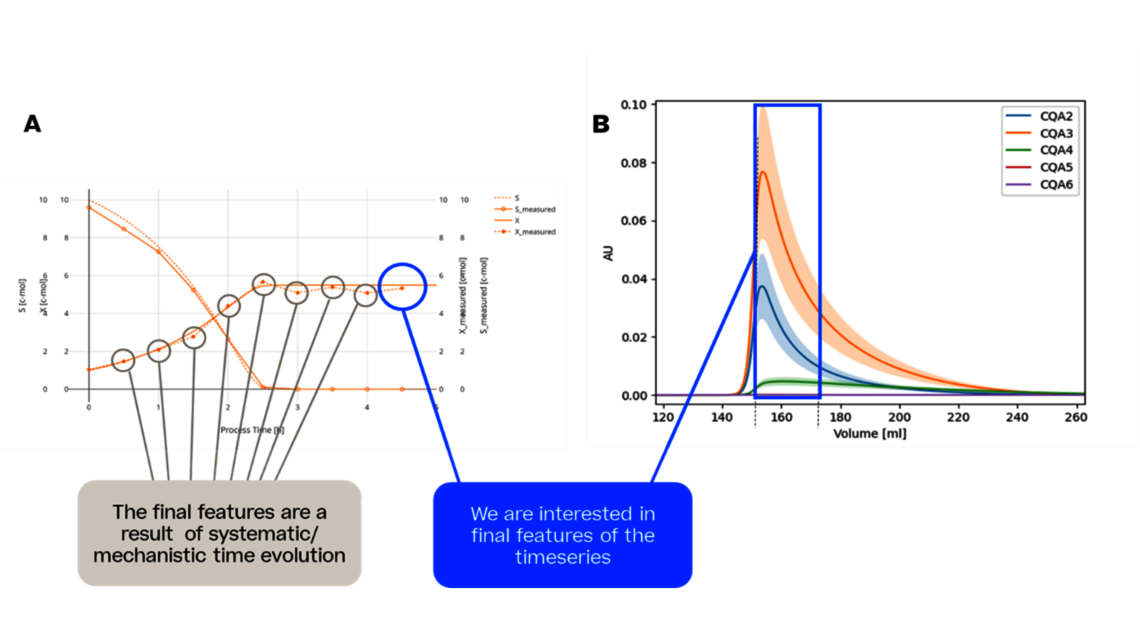
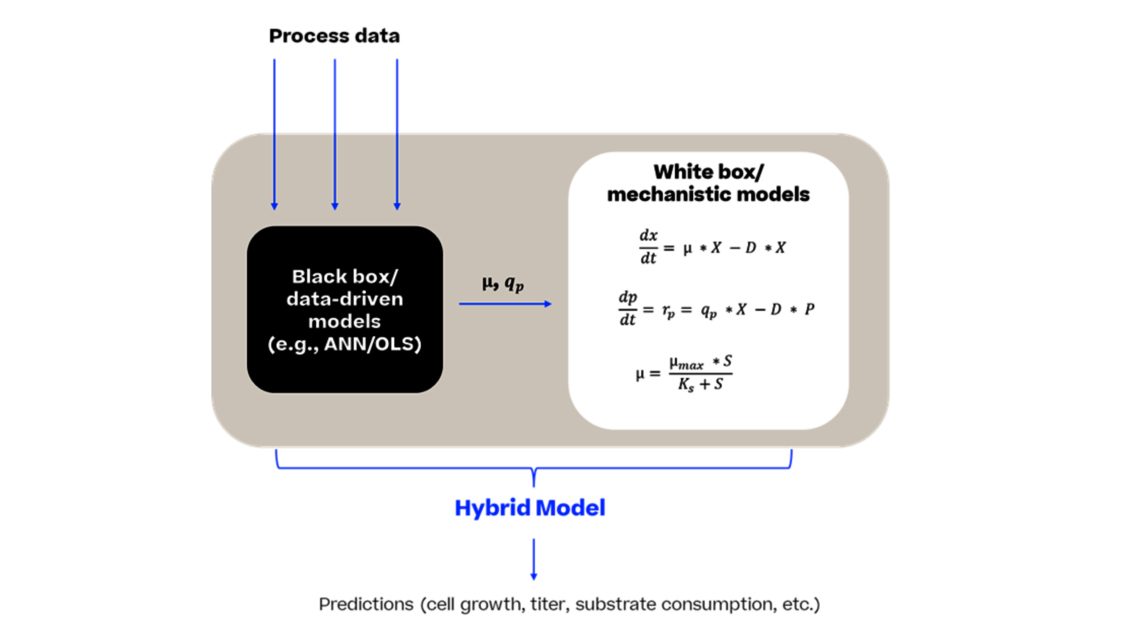
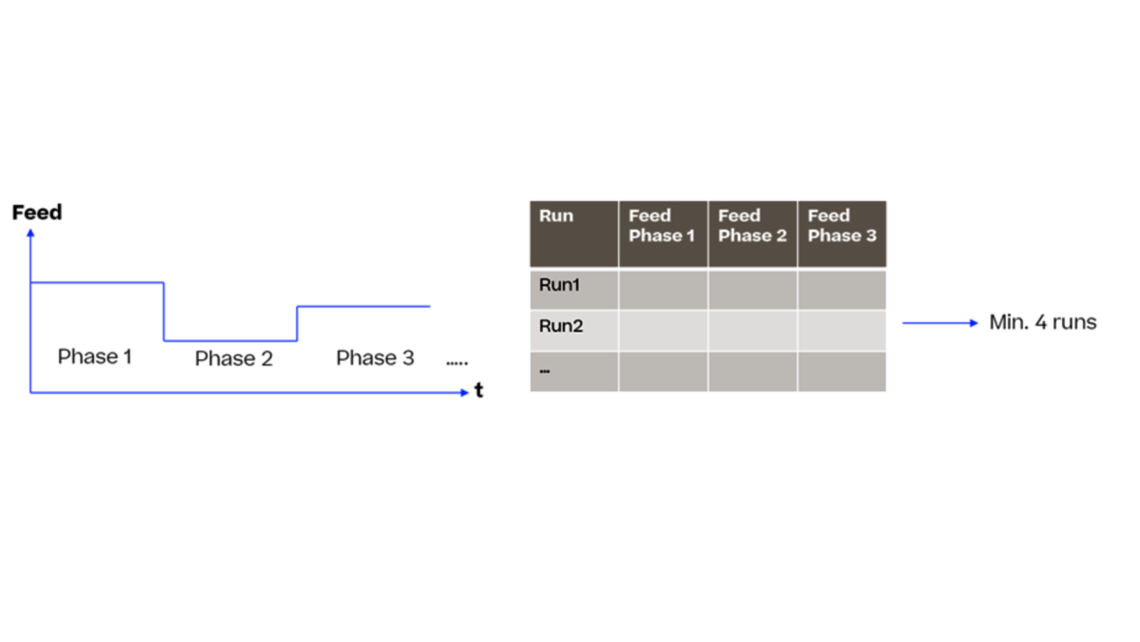
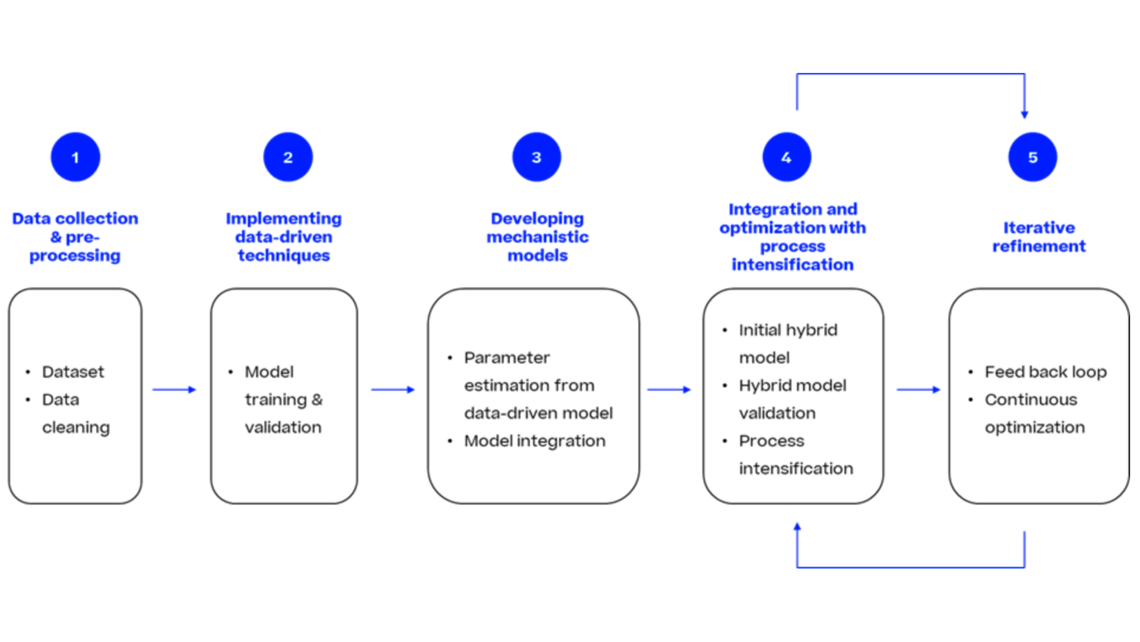
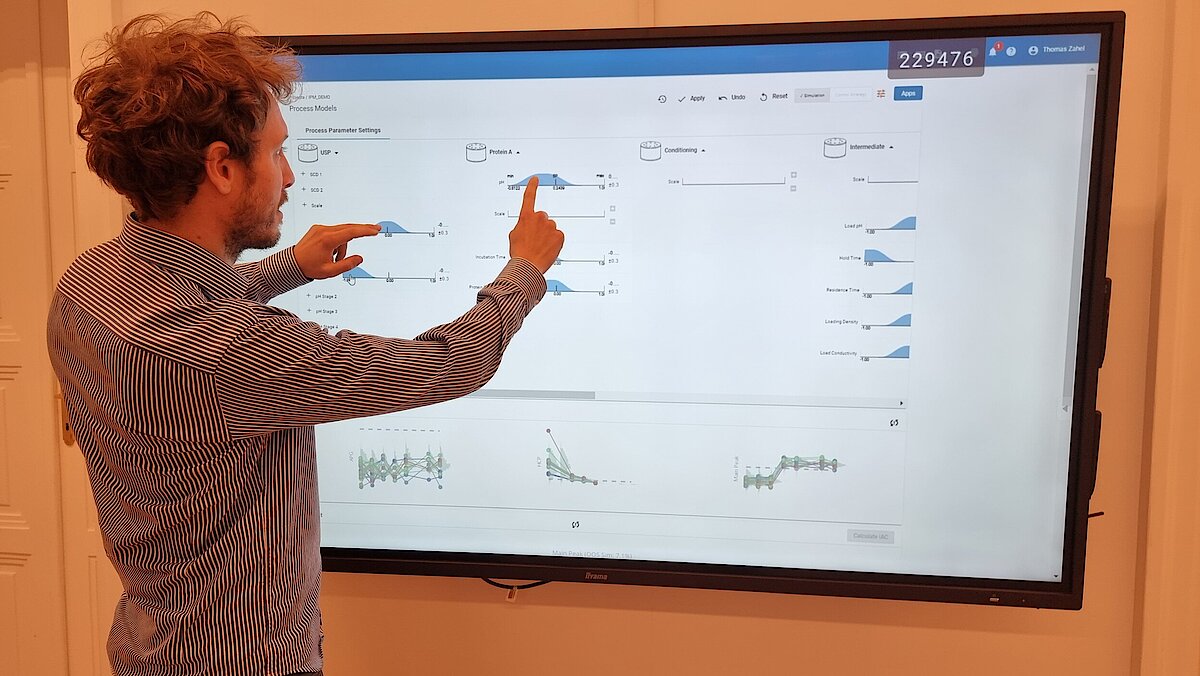
Die steigende Nachfrage nach lebensrettenden Medikamenten auf dem Markt hat dazu geführt, dass modernste Werkzeuge und Techniken eingesetzt werden. Eine Lösung zur Bewältigung dieser komplexen Situation ist der Einsatz innovativer Methoden. In diesem Artikel werden wir eine dieser Methoden, die dynamische Modellierung, als Mittel zur Reduzierung von Experimenten und damit zur Beschleunigung der Prozessentwicklung vorstellen.